发布时间: 2019-07-04 10:13:17
修改时间: 2019-07-04 10:19:31
阅读量: 2605
作者: 骆驼
中学化学知识点很细,需要整理的地方非常多,本文根据福建教师招考中考试大纲对中学化学的要求,梳理了化学反应速率知识点,方便大家更加顺利地开展学习。
一、定义与计算公式
1.定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化。
2.计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L·s)
二、影响因素
1.内因
(1)对于有固体参加的化学反应而言,由于在一定条件下,固体的浓度是固定的,所以固体物质在化学反应中浓度不改变,因此在表示化学反应速率时,不能用固体物质。但因为固体物质的反应是在其表面进行的,故与其表面积有关,当固体颗粒变小时,会增大表面积,加快反应速率。
(2)对于气体反应体系,有以下几种情况:
①恒温时:
增加压强引起(→)体积缩小引起(→)浓度增大引起(→)反应速率加快。
②恒容时:
充入气体反应物引起(→)浓度增大引起(→)总压增大引起(→)速率加快
充入“惰气”引起(→)总压增大,但各分压不变,即各物质的浓度不变,反应速率不变。
③恒压时:
充入:“惰气”引起(→)体积增大引起(→)各反应物浓度减少引起(→)反应速率减慢。
2.外因
外因对化学反应速率影响的变化规律 | |||
条件变化 | 活化分子的量的变化 | 反应速率的变化 | |
反应物的浓度 | 增大 | 单位体积里的总数目增多,百分数不变 | 增大 |
减小 | 单位体积里的总数目减少,百分数不变 | 减小 | |
气体反应物的压强 | 增大 | 单位体积里的总数目增多,百分数不变 | 增大 |
减小 | 单位体积里的总数目减少,百分数不变 | 减小 | |
反应物的温度 | 升高 | 百分数增大,单位体积里的总数目增多 | 增大 |
降低 | 百分数减少,单位体积里的总数目减少 | 减小 | |
反应物的催化剂 | 使用 | 百分数剧增,单位体积里的总数目剧增 | 剧增 |
撤去 | 百分数剧减,单位体积里的总数目剧减 | 剧减 | |
其他 | 光、电磁波超声波、固体反应物颗粒的大小溶剂等 | 有影响 | |
三、化学反应速率图象
图象也是一种表达事物的语言符号,化学反应速率图象是将化学反应速率变化的状况在直角坐标系中以图的形式表达的结果,是化学反应速率变化规律的反映。认识和应用化学反应速率图象时,要立足于化学方程式,应用化学反应速率变化的规律,分析直角坐标系及其图象的涵义。
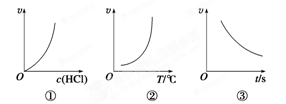
1.化学反应CaCO3+2HCl===CaCl2+CO2↑+H2O
(1)其他条件一定,反应速率随着c(HCl)的增大而增大,如图①。
(2)其他条件一定,反应速率随着温度的升高而增大,如图②。
(3)随着反应时间的延长,c(HCl)逐渐减小,化学反应速率逐渐减小,如图③。
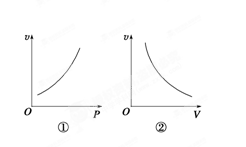
2.化学反应2H2S(g)+SO2(g)===3S↓(s)+2H2O(g)
(1)其他条件一定,增大气态反应物的压强(缩小气体容器的容积),反应速率随着压强的增大而增大。如图①。
(2)其他条件一定,减小气态反应物的压强(扩大气体容器的容积),反应速率随着压强的减小而减小,如图②。
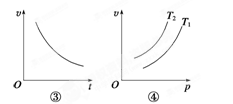
(3)温度、气体容器的容积都一定,随着时间的增加,SO2、H2S物质的量逐渐减少,气体的压强逐渐减小,反应速率逐渐减小,如图③。
(4)分别在较低温度T1和较高温度T2下反应,气态反应物的压强都是逐渐增大(缩小容器容积),反应速率随着压强的增大而增大及随着温度的升高而增大,如图④。
以上就是福建教师招考为您整理推荐的化学反应速率知识归纳梳理,希望给同学们带来帮助。
推荐阅读:
