发布时间: 2019-07-30 10:16:15
修改时间: 2019-07-30 10:19:03
阅读量: 2119
作者: 骆驼
中学化学知识点很细,需要整理的地方非常多,本文根据福建教师招考中考试大纲对中学化学的要求,梳理了离子反应知识点,方便大家更加顺利地开展学习。
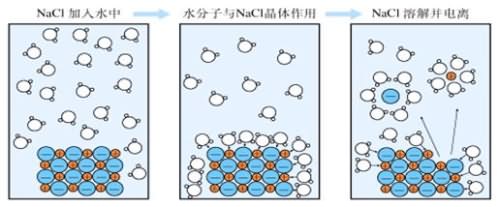
一、电解质、非电解质
电解质 | 非电解质 | |
定义 | 在水溶液中或熔融状态下 能导电的化合物 | 在水溶液中和熔融状态下 均不能导电的化合物 |
本质 | 在水溶液中或熔融状态下 能够电离的化合物 | 在水溶液中和熔融状态下 均不能发生电离的化合物 |
导电实质 | 产生了自由移动的离子 | 没有产生自由移动的离子 |
结构特点 | 离子化合物和某些具有极性键的共价化合物 | 某些共价化合物 |
共同点 | 均为化合物 | |
注意点 | 电解质非、电解质的区分与化合物的水溶性无关. | |
举例 | NaCl Ba(OH)2 CH3COOH | CH3CH2OH C12H22O11 |
二、强电解质、弱电解质
强电解质 | 弱电解质 | ||
定义 | 在水溶液中能全部电离的电解质 | 在水溶液中只能部分电离的电解质 | |
电离程度 | 完全 | 部分 | |
电离平衡 | 不存在 | 存在 | |
溶液中存在微粒种类 | 水合离子、水分子 | 水合离子、水分子 弱电解质分子 | |
电离过程 | 不可逆、不存在电离平衡 | 可逆、存在电离平衡 | |
相互关系 | 均为电解质。在相同条件下,强电解质溶液的导电能力强于弱电解质溶液 | ||
电离方程式 书写规律 | 用等号 HnA=nH++An- | 用可逆符号,弱酸分步电离 HnA | |
举例 | 强酸:HCl H2SO4 HNO3 HClO4 HBr HI 强碱:KOH NaOH Ba(OH)2等. 绝大部分盐:BaSO4 BaCl2. 等 | 弱酸:CH3COOH HCN H2S H2CO3等 弱碱:NH3H2O Cu(OH)2等. H2O及小部分盐:(CH3COO)2Pb等. | |
三、离子反应和离子方程式
1.离子反应:有离子参加或有离子生成的反应。
2.离子方程式:
(1)概念:用实际参加反应的离子符号来表示离子反应的式子。
(2)书写步骤:
①写:正确书写化学方程式。
②改:把易溶于水的强电解质写成离子形式,把其他类别的物质(难溶于水的物质、气体、弱电解质、非电解质、单质、氧化物等)仍用化学式表示。
③删:等量删去方程式两边不参加反应的离子
④查:检查方程式两边各元素原子个数和电荷总数是否相等。
3.离子方程式的意义:
(1)表示某一个具体的化学反应,如: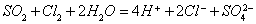 ,只表示
,只表示 。
。
(2)表示同一类型的离子反应,如: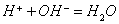 ,可以表示强酸与强碱反应生成可溶性盐的所有中和反应。
,可以表示强酸与强碱反应生成可溶性盐的所有中和反应。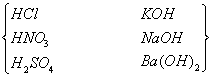
4.复分解型离子反应发生的条件:
(1)生成难溶的物质
(2)生成弱电解质:弱酸、弱碱、水
强酸制弱酸或弱酸制更弱酸: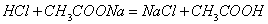
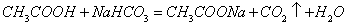
酸性: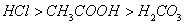
强碱制弱碱:![]()

(3)生成易挥发性物质--气体
四、离子方程式书写注意事项
1.要遵循反应事实,不能臆造化学反应,如: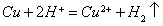 (错)
(错)
2.要遵循元素原子守恒及电荷守恒,如: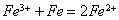 (错)
(错)
3.要遵循拆写原则,如与水反应: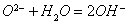 (错)
(错)
4、遵循客观事实,对于微溶的强电解质而言,若是澄清溶液则应将其改写为离子形式;若是浊液则应写成化学式。
5.不能违背约简原则
如:稀硫酸和氢氧化钡溶液反应: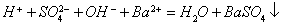 (错)
(错)
正确的为: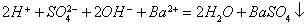 。
。
推荐阅读:
